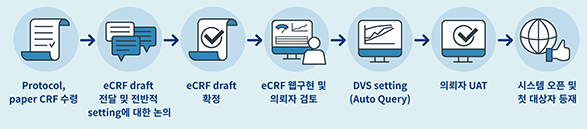
이용안내
- 모니터링실 위치, 규모 및 운영 장비
- 국립암센터 병원동 본관 지하1층 임상연구코디네이터실 내에 위치하며, 모니터링을 위한 장비는 책상, PC, 복사기, 전화기 등이 구비되어 있습니다.
- 예약 신청방법
- 달력에서 예약을 원하는 날짜 중에서 ’예약‘으로 표시된 모니터링 PC를 클릭한 후 예약신청자 정보 및 임상시험센터 모니터링실 신청서를 작성합니다.
※ 비밀번호는 예약 취소 및 입.퇴실 체크시 반드시 필요하므로 개인적으로 메모하여 관리하도록 합니다. - 화면 하단의 ‘예약하기“ 버튼을 클릭합니다.
※ 반드시 승인여부 확인하셔서 불이익 없도록 하시기 바랍니다.
1) 승인 및 예약 거절 여부는 예약신청일로부터 익일 오후 12시 이후 달력에서 확인 바랍니다.
2) 예약 거절된 경우, 예약신청일로부터 익일 1일간 달력에서 거절사유 확인 가능합니다.
- 달력에서 예약을 원하는 날짜 중에서 ’예약‘으로 표시된 모니터링 PC를 클릭한 후 예약신청자 정보 및 임상시험센터 모니터링실 신청서를 작성합니다.
- 예약 취소방법
- 달력에서 예약 신청한 날짜의 모니터링 PC를 클릭 한 후 비밀번호 입력 후 취소사유를 명시 후 ’취소하기‘ 버튼을 클릭합니다.
예약규정사항
- 예약자와 사용자는 일치해야 합니다.
- 매월 1일(09:00)에 다음달 말일까지 좌석이 오픈되며, 이용일로부터 하루전까지 예약신청이 가능합니다.
- 예약취소는 이용일로부터 하루 전까지 가능 합니다.
- 과제별로 최근 2개월간 3회 패널티를 받은 경우 발생시점부터 1개월간 예약이 불가하니 주의 바랍니다.
- 예약 좌석은 한 과제당 1일 최대 2자리까지(단, 비밀번호 다르게 설정), 한달 최대 5자리까지 예약신청이 가능합니다.
- 모니터링실 이용시간은 오전 08:30 ~ 오후 16:30까지입니다.
- 이용 당일 달력 우측 상단의 “입/퇴실하기"부분을 클릭해 입실 체크를 해주셔야 참석으로 인정됩니다.
- 입실 미 체크 시 부재로 간주하여 패널티 적용 됩니다.
- 컴퓨터를 사용하지 않는 경우에도 입실처리 해주셔야 됩니다.
- 예약된 PC번호로 사용 바랍니다.
- 임상시험센터 모니터링실 담당자 연락처:031-920-0396
예약 안내사항
- 1. 임상시험약국 모니터링 예약안내
- 매월 1일(09:00)에 다음달 말일까지 예약이 오픈되며, 이용일로부터 2일전까지 예약신청이 가능합니다.
- 예약취소는 이용일로부터 하루 전까지 가능합니다.
- 2022년 12월부터는 유선으로 모니터링 예약은 받지 않습니다.
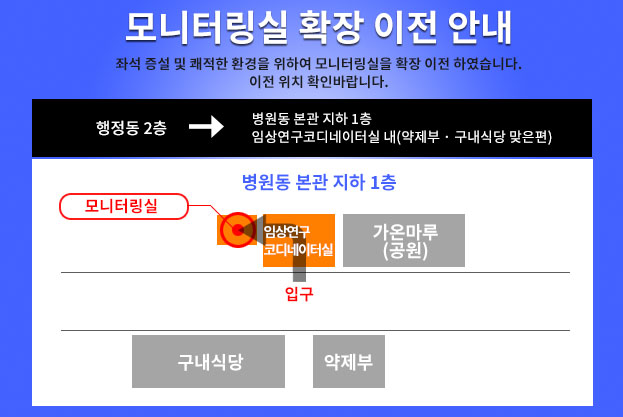
- 2. 임상시험약국 위치
- 국립암센터 병원동 본관 지하 1층 약제부 맞은편
- 3. 임상시험약국 모니터링 시간 : 09:30~17:00
- 9:30에 임상시험약국에 오셔서 약국바인더 픽업하시기 바랍니다
- 09:30분보다 혹여 늦어지시는 경우 미리 연락하여 주시기 바랍니다
- 4. 모니터링 랩업 시간은 09:30~16:30입니다.
- 업무 마감 17:00 고려하여 늦어도 16:00까지 오시기 바랍니다
- 점심교대 시간(11:30~13:30) 제외
- 5. 예약 신청방법
- 달력에서 예약을 윈하는 날짜 중에서 “예약”으로 표시된 곳을 클릭한 후 예약 신청 정보를 입력합니다
- 예약 신청 정보 : IRB 승인 번호와 연구과제명
- 비밀번호는 예약취소 등에 필요하므로 개인적으로 관리하시기 바랍니다.
- 화면 하단의 “예약하기“ 버튼을 클릭합니다
- 6. 예약 취소 방법
- 달력에서 예약 신청한 날짜를 클릭한 후 비밀번호 입력 후 취소사유와 함께 “취소하기“ 버튼을 클릭합니다
예약 안내사항
- 원활한 모니터링을 위해 정확한 IRB 승인번호 (예. 20**0***)와 연구명(프로토콜, 과제약칭 등)을
정확히 기재 하셔서 예약하시기 바랍니다.
임의의 IRB 승인번호 또는 프로토콜명으로 예약하시는 경우에는 모니터링 진행에 어려움이 있어
관리자 권한으로 예약이 취소될 수 있으니 참고하시기 바랍니다.
EMR 열람 신청 안내
국립암센터에서는 원내 수행 임상연구와 관련된 의뢰기간 CRA 및 Auditor들에게 EMR접근 권한을 부여하여 연구의 원할한 진행을 지원하고 있습니다.
신청방법 : 해당 서류 작성 후 병원동 지하 1층 의료정보관리실 방문(신분증 필수 지참)
| 구분 | 제출서류 |
|---|---|
| 열람승인 |
1. 의무기록 열람 및 프로그램 승인 신청서(외부) 2. 개인·의료 정보이용 서약서 3. 의무기록 열람 정보보호보안 서약서 4. 열람 근거 : IRB승인통보서 혹은 관련 공문 5. 환자 명단 : 출력된 환자명단 하단에 연구책임자 서명 후 제출 및 메일발송 13317@ncc.re.kr 6. 신원확인 서류 : 재직증명서 등 |
| 열람신청 | 1. EMR 로그인 신청서 |
| 대상자 명단 추가 |
1. 추가연장 의무기록 열람 신청서 2. 환자 명단 : 출력된 환자명단 하단에 연구책임자 서명 후 제출 및 메일발송 13317@ncc.re.kr |
| 열람기간 연장 |
1. 추가연장 의무기록 열람 신청서 2. 연장 근거 : IRB승인 통보서 혹은 관련 공문 |
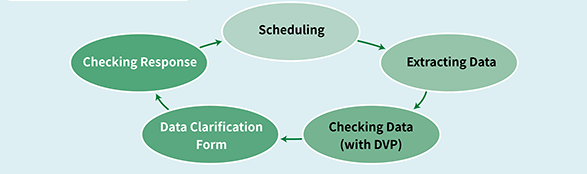
열람 절차
- 외부 : 아이디/패스워드 부여
- 열람 신청 후 저장
- 의료정보관리실 승인
- 열람 가능
의료정보관리실 방문안내
- 열람 신청시간 : 09:00 ~ 11:00 / 13:00 ~ 16:00
- 신분증(명함,사원증 X) 반드시 지참
1달내 모니터링실 예약이 다수 승인된 경우에는 ID발급시 신청기한은 최대1달까지 신청가능하며, 신청시 사유를 작성해주시기 바랍니다.
(하루 사용가능 ID 제한으로 인하여 사용승인이 되었더라도 사용기한의 제한이 있을 수 있음을 미리 양해부탁드립니다. )
EMR 열람신청 관련 문의 : 031)920-0237
- 임상시험센터 031)920-0391
- 민간수탁 계약 031)920-0392, 0396 ctc-contract@ncc.re.kr
- - 계약서 확인사항 다운로드
- 민간수탁 연구비 031)920-0393,0382 cts-rfunds@ncc.re.kr
- - 연구비 계산서 발급요청서 다운로드
- - 환급 계산서 발급요청서 다운로드
- 임상시험 문서보관 031)920-0392, 0396 ctc-contract@ncc.re.kr
- - 문서보관료 산정 요청서 다운로드
- - 문서보관료 산정요청 메일발송 ctc-contract@ncc.re.kr
- - 문서보관료 계산서 발급요청서 다운로드
- 임상시험센터 SOP 031)920-0433
- 약제관리비 의뢰 031)920-0203
- - 약제관리 산정의뢰서 다운로드
- - 약제관리비 최종산정의뢰서 다운로드
- - 약제관리비 산정 요청 메일발송 mej1648@ncc.re.kr
- - 임상시험약국 공용메일(업무관련 문의) nccpharm-ct@ncc.re.kr
- 임상시험약국 모니터링 예약 031)920-0204예약하기 이용안내
- 모니터링실 예약 031)920-0396예약하기 이용안내 EMR열람신청안내
- 팩스 031)920-0439, 0388
- 웹기반 임상연구관리시스템 활용 의뢰 031)920-0390 mytrial@ncc.re.kr
- 임상시험 의뢰 적합성 및 타당성 문의(study feasibility 등) 031)920-0381 oldpia@ncc.re.kr
소개
임상시험센터는 종양전문의 및 간호사와 민간수탁연구수행을 위한 행정인력 등으로 구성되어 있으며, 새로운 암치료법에 대한 계획의 수립, 수행 및 그 효과와 안전성 평가 등 암환자에게 치료를 극대화하고 부작용을 최소화할 수 있는 진료방법개발을 위한 임상연구가 과학적이고 체계적으로 이루어질 수 있도록 함으로써, 임상연구의 향상을 도모하고 있습니다.
| 이근석 임상시험센터장 | 유방암의 항암화학요법 |
|---|
조직도
| 임상시험센터 | |
|---|---|
| 임상시험팀 | 임상시험지원팀 |
|
|
임상시험센터 연혁
- 2000.12 박영석 화학요법센터장 보직 발령
- 2001. 3 임상시험심사위원회 운영
- 2001. 7 의약품임상시험실시기관으로 지정 (KFDA 제2상, 제3상)
- 2002. 3 임상시험센터로 명칭 변경
- 2002. 3 의약품임상시험실시기관으로 지정 (KFDA 제1상)
- 2003. 4 노정실 임상시험센터장 보직 발령
- 2003. 7 미연방 임상시험실시기관 자격 인증 U.S. Department of Health and Human Services(DHHS), Federal-wide Assurance(FWA), OHRP(IRB00003114, FWA00005026, IORG0002553)
- 2005. 8 유전자검사 · 연구기관으로 신고, 기관생명윤리심의위원회 운영
- 2006. 5 김흥태 임상시험센터장 보직 발령
- 2008. 4 이근석 임상시험센터장 보직 발령
- 2008. 8 의료기기 임상시험실시기관으로 지정
- 2009. 2 노정실 임상시험센터장 보직 발령
- 2009. 2 배아연구기관으로 등록
- 2010. 7 IRB 운영위원회 운영
- 2010.11 FERCAP Survey 인증
※Forum for Ethical Review Committees in Asia and Pacific region 아시아 서태평양 윤리위원회 연합포럼 - 2011. 8 KAIRB 평가 통과
※Korea Association of Institutional Review Borards, 대한기관윤리심의기구협의회 - 2012. 7 임상시험병실 6개 병상 오픈
- 2012.12 내부자체점검 수행
- 2013. 9 엄현석 임상시험센터장 보직 발령
- 2013. 9 식품의약품안전처 정기점검(차등평가) A등급
- 2013. 9 식품의약품안전처 우수자체점검기관 평가 합격
- 2018. 1 윤탁 임상시험센터장 보직 발령
- 2018. 2. 임상연구협력센터 통합
- 2018.12 임상시험검체분석기관으로 지정
- 2019. 5 김흥태 임상시험센터장 보직 발령
- 2019.11. 임상시험팀, 임상시험지원팀 조직 신설
- 2021. 3 이근석 임상시험센터장 보직 발령
- 2021. 9 임상시험센터 산하에 첨단세포치료사업실 신설
목표
- 세계적인 수준급 연구중심병원 구축
- 이행성 연구에 기여
- 진료권고안 개발 기여
전략
- 국립암센터 임상시험 활성화 지원
- 다기관 임상시험 지원 및 평가
- 임상연구와 이행성 연구의 연계 체계 구축
- 교육 및 홍보
임상시험이란
신치료기술의 효과와 안전성을 증명하는 과정을 말합니다.
항암제 임상시험의 경우 약물의 안전성과 치료효용성을 증명할 목적으로 해당 약물의 체내 분포, 대상 및 배설, 약리효과와 임상적 효과를 확인하고 부작용 등을 알아보기 위해 사람을 대상으로 실시합니다.
임상시험을 시작하기 위해서는 반드시 의생명연구심의위원회((IRB)에서 임상시험에 참여하는 시험대상자의 권리·안전·복지 등 윤리적 임상시험인지 여부와 과학적인 근거를 갖춘 임상시험인지를 검토하여 승인을 받아야 합니다. 신치료기술 개발도 중요하지만 모든 임상시험 대상자의 권리와 이익을 최우선으로 하여야 합니다.
임상시험은 의학발전을 위하여 꼭 필요한 과정입니다. 임상시험이 있기에 현재 환자들은 신치료기술의 혜택을 받고, 미래의 환자들도 잠재적 이익을 받을 수 있습니다.
임상시험을 시작하기 위해서는 반드시 의생명연구심의위원회((IRB)에서 임상시험에 참여하는 시험대상자의 권리·안전·복지 등 윤리적 임상시험인지 여부와 과학적인 근거를 갖춘 임상시험인지를 검토하여 승인을 받아야 합니다. 신치료기술 개발도 중요하지만 모든 임상시험 대상자의 권리와 이익을 최우선으로 하여야 합니다.
임상시험은 의학발전을 위하여 꼭 필요한 과정입니다. 임상시험이 있기에 현재 환자들은 신치료기술의 혜택을 받고, 미래의 환자들도 잠재적 이익을 받을 수 있습니다.
임상시험에 참여하려면
국립암센터에서 수행되는 임상시험은 대부분 암환자가 대상입니다.
특히 항암제 임상시험은 치료목적으로 진행되는 경우가 많기 때문에 환자입장에서 최신 의약품을 미리 접할 수 있는 기회가 될 수 있습니다.
신약개발단계는 신물질발견 → 비임상(동물)실험 → 임상시험계획승인 → 제1상 임상시험(사람에게 처음 투여, 약물의 흡수/분포/대사/배설을 검토하여 부작용 및 안전한 약물용량 확인) → 제2상 임상시험(약물의 유효성과 안전성 증명) → 제3상 임상시험(시험약의 유효성 확립 후 최종적으로 확증시험) → 신약허가 심사 및 시판허가까지 5∼10년의 시간이 필요합니다.
이처럼 여러 단계를 거쳐 진행되기 때문에 임상시험은 정밀한 계획서에 의하여 수행되어야 합니다. 이를 연구계획서(프로토콜)라고 합니다. 연구계획서(프로토콜)에는 참여 가능한 환자의 선정기준과 그렇지 못한 선정제외기준이 있으며, 이 기준은 연구결과의 신뢰성을 보장하는 중요한 원칙입니다. 임상시험마다 연구계획서(프로토콜)가 정해져 있고 각각 선정/제외 기준을 적용하게 되므로 사전에 해당 연구에 적합한지 확인하는 과정을 거쳐야 합니다.
국립암센터는 연구중심병원으로 각 질환별 센터에서 임상시험을 수행하고 있습니다. 임상시험 대상자로 참여를 원할 시 각 질환별 외래로 연락하시어 안내를 받으시기 바랍니다.
신약개발단계는 신물질발견 → 비임상(동물)실험 → 임상시험계획승인 → 제1상 임상시험(사람에게 처음 투여, 약물의 흡수/분포/대사/배설을 검토하여 부작용 및 안전한 약물용량 확인) → 제2상 임상시험(약물의 유효성과 안전성 증명) → 제3상 임상시험(시험약의 유효성 확립 후 최종적으로 확증시험) → 신약허가 심사 및 시판허가까지 5∼10년의 시간이 필요합니다.
이처럼 여러 단계를 거쳐 진행되기 때문에 임상시험은 정밀한 계획서에 의하여 수행되어야 합니다. 이를 연구계획서(프로토콜)라고 합니다. 연구계획서(프로토콜)에는 참여 가능한 환자의 선정기준과 그렇지 못한 선정제외기준이 있으며, 이 기준은 연구결과의 신뢰성을 보장하는 중요한 원칙입니다. 임상시험마다 연구계획서(프로토콜)가 정해져 있고 각각 선정/제외 기준을 적용하게 되므로 사전에 해당 연구에 적합한지 확인하는 과정을 거쳐야 합니다.
국립암센터는 연구중심병원으로 각 질환별 센터에서 임상시험을 수행하고 있습니다. 임상시험 대상자로 참여를 원할 시 각 질환별 외래로 연락하시어 안내를 받으시기 바랍니다.




![계약서리뷰(의뢰기간 - 임상시험센터 계약 담당자) 및 약제관리 산정 의뢰(의뢰기관 - 약제부) - 민간수탁연구사업 [신규] 계약 요청서 접수(임상시험센터) : 수시 - 신규계약체결 ※ 심의소위원회 심의 및 연구사업심의 필요과제 안건 상정/승인 후 계약체결 - 실행예산편성신청(연구책임자): MIS등록 - 연구비 입금 후 계산서발급요청서 작성하여 메일(의뢰기관 - 임상시험센터 연구비 담당자)](images/sub/sub03/testing_img2.gif)
![계약서리뷰(의뢰기간 - 임상시험센터 계약 담당자) - 민간수탁연구사업 [변경] 계약 요청서 접수(임상시험센터) : 수시 - 변경계약체결](images/sub/sub03/testing_img3.gif)