연구목표 및 분야
생물의약품생산실
생물의약품은 분자생물학적 또는 세포생물학적 연구결과를 응용하여 만들어진 의약품으로, 주로 유전자, 재조합 단백질, 항체, 세포 등을 이용하여 만들어진다. 국립암센터생물의약품생산실은 면역세포를 기반으로 임상시험용 의약품을 제조/공급하고 있다. 특히 표준치료가 불가능한 암환자의 치료에도 효과적인 것으로 평가 받고 있는 암세포만을 표적으로 하는 T 세포를 이용한 adoptive T cell therapy의 임상시험을 위해 자가유래 항암 T 세포를 제조/공급하고 있다.
임상시험용 생물의약품 제조시설
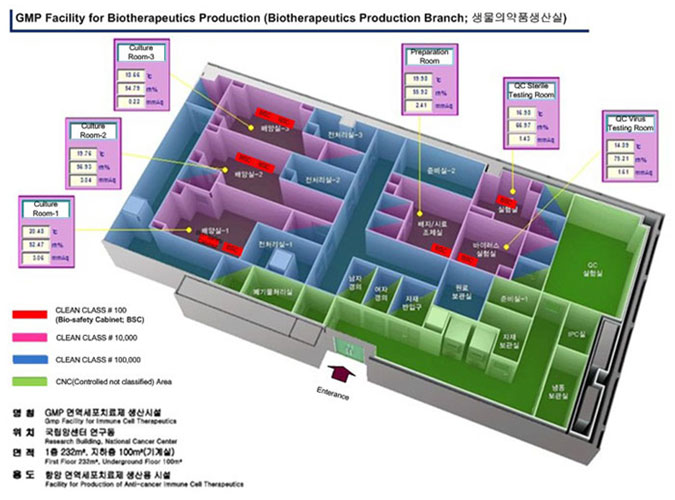
국립암센터생물의약품생산실은연구동 1층에 제조 및 품질관리를 위한 공간 (264 m2)과 연구동 지하1층에 4대의 공조시설 (99 m2)을 갖추고 있으며, 생물의약품생산실을 cGMP 기준에 부합되도록 운영/유지하기 위한 기준서, 방법서, 기록서를 갖추어 운영하고 있다. 생물의약품생산실은 제조구역과 품질보증/관리를 위한 구역으로 나뉘어 있으며, 제조구역은 3개의 clean room (10,000 class)을 포함하고 있으며, 품질보증/관리구역은 세균, 진균, 바이러스 시험을 위한 2개의 clean room (10,000 class)을 포함하고 있다. 이를 기반으로 국립암센터생물의약품생산실은 제1, 2상 임상시험을 위한 자가유래 T 세포치료제를 제조/공급하고 있다.
- GMP Facility for Biomedicine Production
(Biomedicine Production Branch; 생물의약품생산실) - 명칭 : GMP 생물의약품 생산시설 (Gmp Facility Biomedicine Production)
- 위치 : 국립암센터 연구동 (Research Building, National Cancer Center)
- 면적 : 1층 264㎡, 지하층 99㎡(기계실) First Floor 264㎡, Underground Floor 99㎡
- 용도 : 항암 면역세포치료제 생산용 시설(Facility for Production of Anti-cancer Immune Cell Therapeutics)
- 제조구역 Clean Room
- 제조구역은 class 10,000 zone으로 청정도를 유지하고 있으며, 각각의 Clean Room에는 2대의 무균작업대 (class 100 zone)와 세포배양을 위한 CO2 세포배양기가 구비되어 무균상태에서 생물의약품을 제조할 수 있도록 디자인되어 있다. 이를 통해 생물의약품생산실에서 제조되는 임상시험용의약품들이 cGMP 기준에 부합되도록 하고 있다.

- 품질보증/관리 Clean Room
- 품질보증/관리구역은 세균 및 바이러스 시험을 위한 2개의 청정구역과 물리화학적 시험을 위한 일반구역을 포함하고 있으며, 반제품 및 완제품에 대한 시험을 cGMP 기준에 부합되도록 방법서에 따라 시험하고 있다.

생물의약품의 종류
- 앱비앤티셀 (EBViNT Cell)은 EBV 양성 림프종 환자를 대상으로 안전성 및 효력을 시험하기 위한 제1상 임상시험용 생물 의약품으로 임상시험 종료.
- 위티앤티셀 (WTiNT Cell)은 악성 뇌종양인 교모세포종 (glioblastoma) 환자를 대상으로 안전성 및 효력을 시험하기 위한 제1상 임상시험용 생물의약품으로 현재 제조 공급 중.
- 터티앤티셀 (TERTiNT Cell)은 더 이상의 표준치료가 어려운 고형암 환자를 대상으로 안전성 및 효력을 시험하기 위한 연구자 임상시험용 생물의약품으로 현재 제조 공급 중.
- 임상시험 승인신청 및 수행을 위한 협력체계
- 생물의약품생산실은 연구개발 부서에서 새롭게 개발된 세포치료제의 생산프로토콜을 기반으로 제조공정 및 시험생산을 수행하며, 동시에 임상시험계획 및 IRB 승인에 필요한 행정적 지원을 수행한다. 임상시험승인 후에는 임상시험 팀으로부터 피험자의 혈액과 같은 제조원료를 제공받아 세포치료제를 제조/공급한다. 따라서 생물의약품생산실은 연구개발팀, 행정지원팀, 임상시험팀과 협력하여 새로운 생물의약품의 임상시험이 원활하게 수행될 수 있도록 한다.
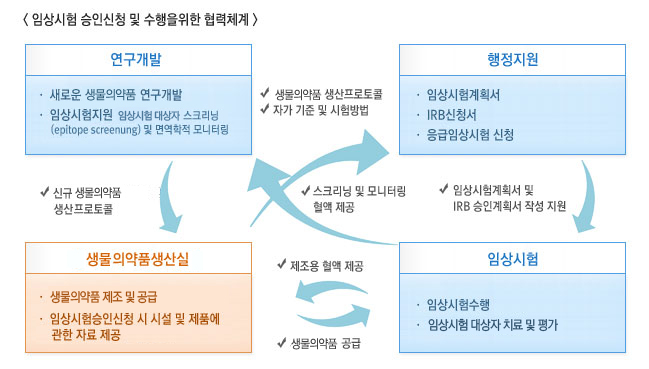 연구개발:새로운 세포치료제 연구개발, 임상시험지원피험자 스크리닝 및 면역학적 모니터링, 행정지원:임상시험계획서, irb신청서, 응급임상시험 신청, 임상시험 : 임상 시험수행, 피시험자치료 및 평가, 생물학정의약품생산실: 생물의약품 제조 및 공급, 임상시험승인신청 시설 및 제품에 관한 자료 제공, 연구개발 - 생물학정의약품 생산실(신규세포치료제 생산 프로토콜), 연구개발 - 행정지원(세포치료제 생산프로토콜, 자가 기준 및 시험방법), 행정지원- 임상시험(임상시험계획서 및 irb 승인계획서 작성지원), 임상시험-연구개발(스크리닝 및 모니터링 혈액제공), 임상시험-생물학정의약품생산실(제조용혈액제공, 세포지표제 공급)
연구개발:새로운 세포치료제 연구개발, 임상시험지원피험자 스크리닝 및 면역학적 모니터링, 행정지원:임상시험계획서, irb신청서, 응급임상시험 신청, 임상시험 : 임상 시험수행, 피시험자치료 및 평가, 생물학정의약품생산실: 생물의약품 제조 및 공급, 임상시험승인신청 시설 및 제품에 관한 자료 제공, 연구개발 - 생물학정의약품 생산실(신규세포치료제 생산 프로토콜), 연구개발 - 행정지원(세포치료제 생산프로토콜, 자가 기준 및 시험방법), 행정지원- 임상시험(임상시험계획서 및 irb 승인계획서 작성지원), 임상시험-연구개발(스크리닝 및 모니터링 혈액제공), 임상시험-생물학정의약품생산실(제조용혈액제공, 세포지표제 공급)
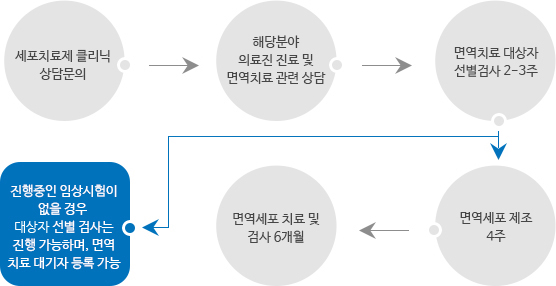
- 세포치료 임상실험 절차(환자용)
최종 수정일 : 2016.10.14